Enhertu, una terapia contra el cáncer dirigida de los socios AstraZeneca y Daiichi Sankyo, ahora puede usarse como tratamiento de primera línea para casos avanzados de cáncer de mama, lo que la convierte en la primera
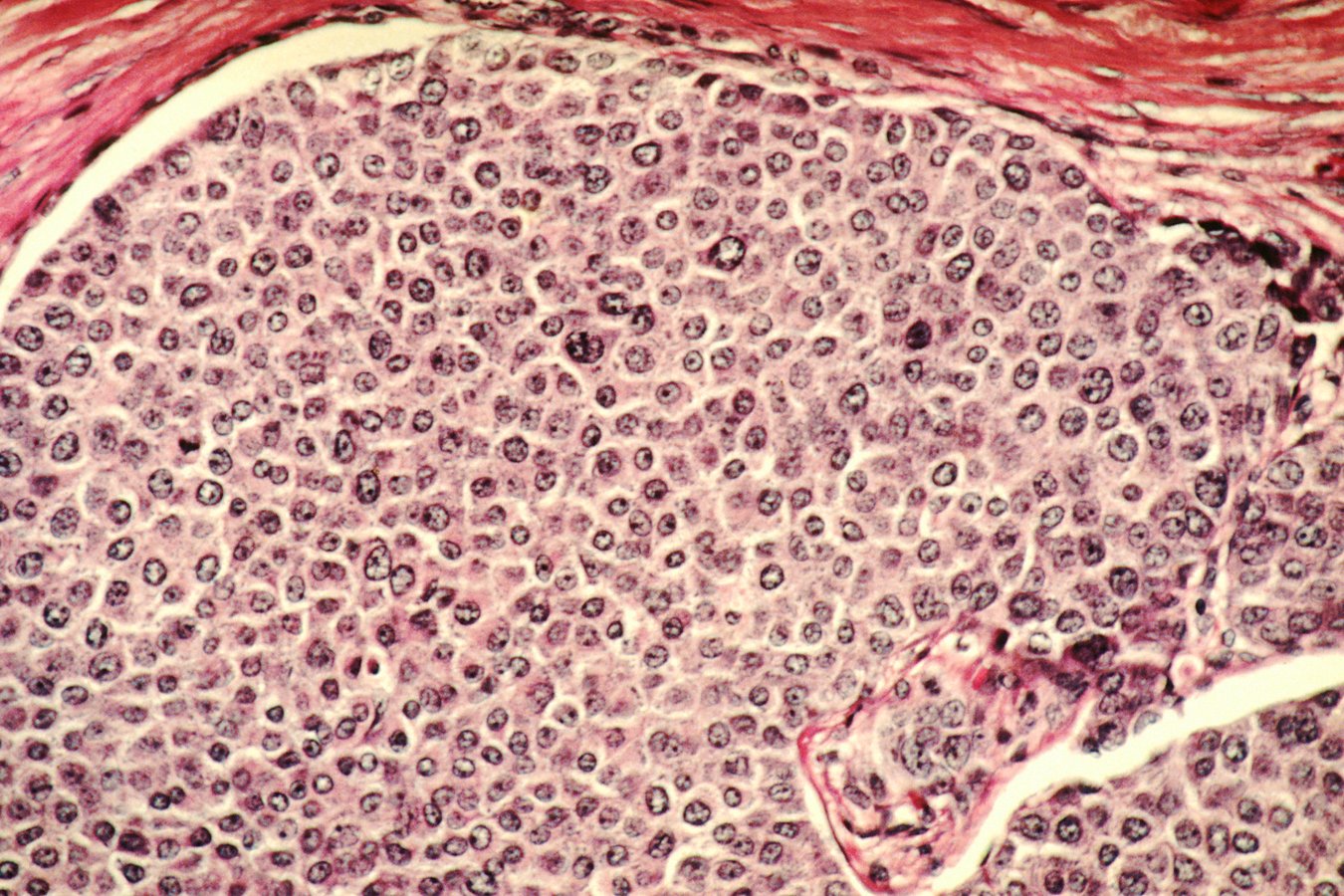
Enhertu se dirige a HER2, una proteína que puede sobreexpresarse en la superficie de las células cancerosas. La aprobación regulatoria ampliada es importante para los pacientes con cáncer de mama porque HER2 hace que los tumores sean agresivos y más difíciles de controlar, lo que significa que muchos pacientes no viven lo suficiente para recibir una segunda línea de tratamiento. La decisión regulatoria anunciada el lunes afecta el tratamiento de adultos cuyo cáncer de mama metastásico o irresecable es HER2 positivo. El La FDA también ha aprobado dos diagnósticos complementarios. para seleccionar pacientes que sean elegibles para el tratamiento con este medicamento, que pertenece a la clase de terapia conjugada anticuerpo-fármaco (ADC).
“Con esta aprobación, llevamos a Enhertu a la fase más temprana del cáncer de mama metastásico HER2 positivo, donde la optimización de la eficacia tiene un impacto importante en los resultados a largo plazo”, afirmó Dave Fredrickson, vicepresidente ejecutivo de la unidad de negocios de Oncología-Hematología de AstraZeneca, en una declaración preparada.
El tratamiento estándar de primera línea para el cáncer de mama HER2 positivo consistía en tres medicamentos: taxano, trastuzumab (nombre comercial Herceptin) y pertuzumab (Perjeta), una combinación a menudo abreviada como THP. La nueva aprobación de Enhertu se basa en los resultados de un ensayo de fase 3 de tres grupos en el que los pacientes fueron asignados aleatoriamente para recibir Enhertu, Enhertu más Perjeta o THP.
Para la principal medida de resultado de supervivencia libre de progresión, la mediana fue de 40,7 meses en el grupo de Enhertu más Perjeta en comparación con 26,9 meses en el grupo de THP. En el momento de este análisis, la supervivencia general era inmadura ya que 126 pacientes habían muerto en ambos brazos del estudio. Los resultados detallados se presentaron a principios de este año durante la reunión anual de la Sociedad Estadounidense de Oncología Clínica. publicado
La aprobación de Enhertu por parte de la FDA en el tratamiento de primera línea incluye el uso del medicamento con Perjeta. El ADC se aprobó originalmente en 2019 como tratamiento de tercera línea para el cáncer de mama HER2 positivo y avanzó a tratamiento de segunda línea en 2022. Al anunciar la nueva aprobación de Enhertu por parte de las compañías, la Dra. Sara Tolaney, jefa de la división de oncología mamaria del Dana-Farber Cancer Institute e investigadora principal del ensayo fundamental del fármaco, dijo que Enhertu más Perjeta debería convertirse en un nuevo estándar de atención de primera línea para HER2 positivo. metastatic breast cancer.
Enhertu was discovered by Daiichi Sankyo. En 2019, antes de la aprobación inicial del medicamento por parte de la FDA, AstraZeneca y Daiichi Sankyo comenzaron a colaborar en el ADC. Las dos empresas participan en el desarrollo y comercialización de Enhertu en todo el mundo, excepto en Japón, donde Daiichi Sankyo posee todos los derechos del fármaco. The partners got in touch in 2024 un aumento de más del 46% respecto al año anterior.
Tras la aprobación estadounidense de Enhertu para uso de primera línea en cáncer de mama HER2 positivo irresecable o metastásico, Daiichi Sankyo dijo que AstraZeneca debía realizar un pago histórico de 150 millones de dólares.
Dominio público Imagen