En gota, la selección farmacéutica para pacientes sigue siendo limitada. La prehistoria de este campo incluye muchas moléculas que han estado en la clínica o en el mercado por razones de seguridad. James Mackay sabe que ha dirigido una compañía de primera mano que desarrolló dos de estos productos retirados.
Mackay ha vuelto a intentarlo de nuevo. Ahora es CEO de Crystal’s Therapeutics, cuyos activos principales son un candidato a la droga de gota con licencia con validación de su aprobación en varios países asiáticos y datos de seguridad adicionales del uso real en estas regiones. El martes Crystalys Dio a conocer $ 205 millones Para las pruebas de fase 3 que podrían apoyar los planes para finalmente llevar esta pequeña molécula a los pacientes en los EE. UU. Y otros mercados.
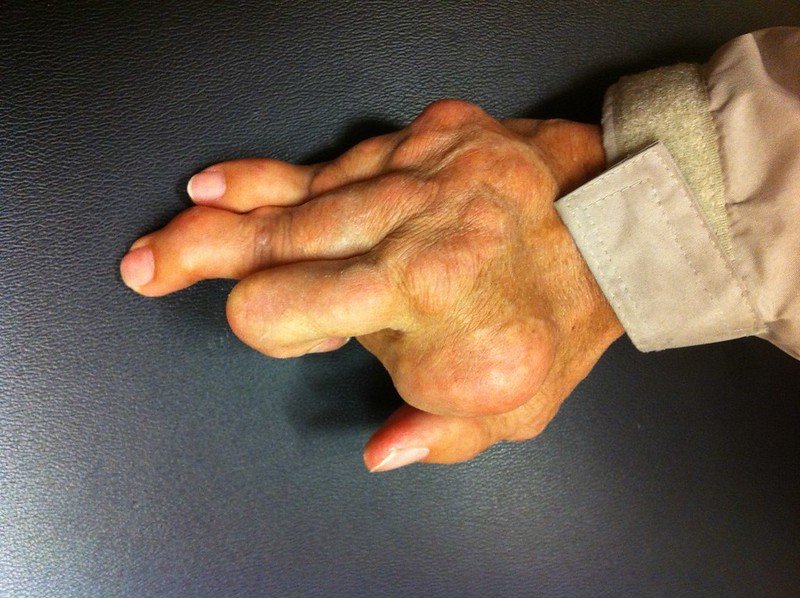
La gota, una forma común de artritis inflamatoria, proviene de altos niveles de ácido úrico en la sangre, que forma cristales en las articulaciones y los tejidos circundantes y causa inflamación y dolor. El trastorno se caracteriza por ataques repentinos de dolor e hinchazón en las articulaciones, que se llaman antorchas de gota. Los pacientes con gota no controlada durante un largo período de tiempo desarrollan depósitos de ácido úrico en las articulaciones, que se denominan pHU de gota. Estos tophi pueden no ser dolorosos, pero pueden afectar y distorsionar el movimiento articular.
El tratamiento de medicamentos estándar para la gota es el alopurinol, un medicamento de 60 años que inhibe una clave enzimática para producir ácido úrico. Esta píldora solo ayuda a aproximadamente el 40% de los pacientes con gota, dijo Mackay. Kristally con sede en San Diego sigue un enfoque diferente con su medicamento Dotinurad. La pequeña molécula oral está diseñada de tal manera que bloquea URAT1, una proteína responsable de la reacción del ácido úrico en el riñón. Por lo general, las personas venden exceso de ácido úrico a su orina. Dotinurad está destinado a ayudar a los pacientes con gota a hacer esto.
“Si bloquea la furgoneta (proteína), básicamente orina más ácido úrico”, dijo Mackay. “Lo que es hermoso sobre su mecanismo es que afecta la causa principal de la gota, a saber, la incapacidad de excretar suficiente ácido úrico. Básicamente, los lleva a desconectarse más y así reducir el nivel de ácido úrico en el cuerpo”.
Mackay está familiarizado con los inhibidores de URAT1 porque la desarrolló en una antigua compañía, Ardea Biosciences. El principal candidato farmacológico de Ardea, Lesinurad, alcanzó el desarrollo de la fase 3 en Gicht cuando la biotecnología fue adquirido por AstraZeneca 2012 por aproximadamente mil millones de dólares estadounidenses. 2015 el La FDA ha aprobado el medicamentoquien llegó al mercado bajo la marca Zurampic. Esta droga y la combinación de lsisinurad y alopurinol, que se conocieron como Duzallo, fueron retirados más tarde del mercado por razones comerciales. Según Mackay, los riesgos de la oxicidad renal hicieron que estos medicamentos fueran desafiantes. No espera estos problemas para Dotinurad, que tiene un perfil de seguridad y efectividad que se define por su uso en más de 1.2 millones de pacientes con gota en Japón.
Dotinurad fue descubierto y desarrollado por la compañía japonesa Fuji Yakuhin, quien dirigió la molécula para su aprobación oficial en su país de origen en 2020. Eisai tiene derechos sobre la droga en varios otros países asiáticos. En 2021, la biológica Urica Therapeutics Fortress adquirió los derechos estadounidenses y europeos de Dotinurad; Al año siguiente, el acuerdo de licencia se amplió a Medio Oriente y África del Norte. Urica expandido Dotinurad a Prueba de fase -1 En voluntarios sanos y pacientes con gota.
Según Mackay, Novo Ventures, que había invertido en otra compañía que había dirigido, se volvió para ingresar al Gichtraum. En vista de la experiencia de Mackay en Gicht, querían su experiencia y experiencia.
“Básicamente asumimos y llevamos a cabo un paisaje de acuerdo con todas las moléculas en el desarrollo”, dijo. “Hemos identificado como el hecho de que tuvimos para el mejor perfil de seguridad y eficacia. Y recurrimos a los agentes terapéuticos de Urica y finalmente los convencimos de que deberíamos adquirir un activo financiero de la licencia de Fuji”.
En julio de 2024, Urica vendió derechos a Doinurad a los derechos de cristal para el 35% del patrimonio pendiente de la biotecnología joven, por lo tanto. Presentaciones regulatorias de la fortaleza. El acuerdo también pone en línea una tarifa de licencia del 3% para la futura facturación neta del medicamento.
Dotinurad podría ayudar a cerrar el intestino en el tratamiento de la gota en la segunda línea en la que desaparecen las opciones de tratamiento. Además de la retirada del mercado de Ardeas, Takeda Pharmaceutical Febuxostat, marca Uloric, abandona el mercado. Esta droga, que ofrece un mecanismo de acción similar como alopurinol, ha ganado Aprobación de la FDA en 2009. Una década después, la FDA agregó una advertencia de caja negra a la etiqueta Ulórics, que marcó la característica Un mayor riesgo de complicaciones cardiovascularesincluyendo la muerte. Takeda ha decidido establecer el producto que actualmente está expuesto a una competencia genérica. Según las grabaciones de la FDA, Takeda será Terminar la distribución uloral En marzo de 2026.
AMGEN Drug Krystexxa está disponible como tratamiento de gota en la tercera línea. Este medicamento es una versión técnica de la enzima que construye ácido úrico. Pero Krystexxa debe administrarse por vía intravenosa. Otra restricción es que los sistemas inmunes del paciente pueden producir anticuerpos que finalmente hacen que la medicina biológica sea ineficaz.
Hay otras compañías que desarrollan inhibidores de URAT1 que posiblemente podrían competir con Dotinurad de Crystalys. La terapéutica Arthrosi, con sede en San Diego, es AR882; La terapéutica atómica con sede en China desarrolla ABP-671. Ambos están en la Fase 3. Si estos medicamentos se basan en la misma columna vertebral molecular que el Zurampic retirado de Adrea, probablemente tendrán los mismos problemas de toxicidad renal, dijo Mackay. Una mejor seguridad para Dotinurad es parte del diseño de la molécula.
La investigación en inhibición de URAT1 para el tratamiento de datos de gota en la década de 1970 llamó al desarrollo de una molécula Benzbromarona. Este medicamento se obtuvo en la aprobación regulatoria de algunos países, pero nunca el Benzbromaron de los Estados Unidos se vio obstaculizado por informes sobre la oxicidad del hígado. Según Mackay, los químicos de Fuji Yakuhin Dotinurad diseñaron para eliminar los problemas de la oxicidad renal que se observaron en inhibidores de URAT1 anteriores. Su trabajo también eliminó la hepatotoxicidad observada con Benzbromaron.
Dotinurad es muy específico para la proteína URAT1 y no deja a otros transportadores renales afectados, dijo Mackay. Como resultado, hay una liberación controlada de ácido úrico durante 24 horas. Otros inhibidores de URAT1 han demostrado un aumento en la excreción de ácido úrico, dijo Mackay. Si empuja demasiado ácido úrico a través del riñón en poco tiempo, conduce a una cristalización del ácido úrico que daña el riñón, explicó.
“Creemos que (Dotinurad) no tiene esta responsabilidad y la etiqueta japonesa o china no son necesarias para el monitoreo renal”, dijo Mackay. “Y obviamente los japoneses lo han dado a más de un millón de pacientes desde el inicio, y no se ha identificado una señal renal tóxica”.
El financiamiento de Crystalys, una ronda de la Serie A, fue fusionada por Novo Holdings, SR One y Catoolys Pacific. Otros participantes incluyen Perception -Xontogeny Venture Funds, Lightstone VC, A Venture Partners, fondos, administrados por ABRDN Inc., KB Investments, Pontifax, Longwood Fund, Alexandria Venture Investments, Wedbush Healthcare Partners y Prebys Ventures.
Con la nueva capital, Crystalys Dotinurad está conduciendo directamente a dos estudios de fase -3, y uno evalúa el efecto del fármaco en las antorchas de gota y las otras pruebas de la resolución Tophus. En vista del extenso estudio clínico y datos reales para el fármaco en Asia, la FDA permite que los cristales se salten las pruebas de fase 2, dijo Mackay. La única disposición es que la FDA finaliza una cierta dosis en la fase 3 del programa, de modo que uno de los estudios evaluará una dosis de 2 mg y una dosis de 4 mg. Los estudios tienen una inscripción específica de alrededor de 750 pacientes. Mackay espera datos de estos experimentos a fines de 2027.
Foto del usuario de Flickr Manual Acerca de un creative commons Licencia